Siglo y medio de Tabla Periódica
Ciencia Abierta
Se cumplen 150 años de la propuesta de Mendeleiev, un ruso con aire dickensiano

La existencia de hechos y fenómenos periódicos son, con gran probabilidad, uno de los orígenes de la actividad científica humana. Buscamos como explicar el devenir repetido de las estaciones, las fases de la luna, los cambios más o menos cíclicos de los planetas en los cielos, o las variaciones en nuestra actividad vital, el ciclo sueño-vigilia y otros tantos procesos que se repiten con un cierto periodo. Las matemáticas describen esa periodicidad con sus funciones clásicas que alternan subidas y bajadas en sus gráficos. En todo ello hay una gran belleza.
El año que discurre, 2019, ha sido declarado por la ONU como Año Internacional de la Tabla Periódica de los Elementos Químicos. La imagen de la tabla periódica, en su forma tabular con 18 columnas, es una de las representaciones de la ciencia más conocida por cualquier estudiante de ciencias (y digamos que también de letras). Pueden hallarse múltiples variaciones de su imagen, con colores variados e introduciendo más o menos información en cada una de sus casillas. Esencialmente, la tabla organiza los elementos químicos en orden creciente de número atómico (denominado con la letra Z) y sus configuraciones electrónicas, según filas (los periodos) y columnas (los grupos). Con dicha ordenación se pueden estudiar las propiedades físicas y químicas que comparten los elementos químicos de un mismo grupo de esos elementos.
Desde sus orígenes como ciencia que estudia la materia, los químicos apreciaban que las sustancias conocidas compartían ciertas propiedades. Pongamos 1661, con Robert Boyle, la distinción entre elemento y compuesto; y a partir de entonces se empiezan a estudiar las propiedades de los elementos químicos ya conocidos y de todos aquellos que se van descubriendo durante el siglo XVIII y XIX. En este último siglo empieza a ser evidente, dada la gran cantidad de elementos químicos descubiertos, y no digamos de sustancias que va desarrollando la industria, que se hace necesario clasificar esa enorme diversidad. ¿No habían logrado los biólogos hacer una clasificación, basada en el sistema de Linneo, de su gigantesca diversidad de seres vivos? ¿Cómo podría la química, alabado sea Lavoisier, dar un orden sistemático a sus conocimientos?
Y no sería por intentos. Ya en 1718 Etienne Francoise Geoffroy construyó una tabla de afinidades en base a propiedades superfluas como la apariencia; y así se suceden diversas propuestas, incluida la de Lavoisier, que intentan ordenar los elementos químicos según propiedades. Empero, ninguna logra "colocar" a los elementos en un único lugar o en base a un único criterio.
Dobereiner, hacia 1820, construye las llamadas triadas (calcio-estroncio-bario; litio-sodio-potasio; y alguna más); Odling en 1857 hace una nueva propuesta en base a otras propiedades. En todos los casos, ninguna propuesta consigue ordenar los elementos químicos conocidos en esos momentos. La situación era irritante y se mezclaba con la confusión de la terminología y la nomenclatura química. Los químicos empezaban a no poder entenderse entre sí y aquello parecía tan confuso como el lenguaje de la alquimia medieval (Lavoisier nos perdone).
A propuesta de Friedrich August Kekulé, entre el 3 y el 5 de septiembre de 1860, se celebra en la ciudad alemana de Karslruhe, el Primer Congreso Internacional de Química. Asisten 127 delegados de 12 países (Bélgica, Alemania, Inglaterra, Francia, Italia, México, Austria, Portugal, Rusia, Suiza, Suecia y España). El único español fue Ramón Torres Muñoz de Luna (1822-1890), eminente químico y farmacéutico español de la época. En el congreso se ponen término a las divergencias sobre la denominación y los símbolos de los elementos químicos y con ello se consigue avanzar en la racionalización de la nomenclatura química. En el congreso las ideas del italiano Stefano Cannizaro sobre el peso atómico y el peso molecular fueron aceptadas, con ello la idea de crear una tabla de elementos podía avanzar.
En los años siguientes aparecen nuevas propuestas de clasificación: En 1862, el tornillo telúrico del geólogo francés Alexander Emile Beguyer de Chancourtrais; en 1864, las octavas del inglés John Alexander Reina Newlands; ese mismo año una tabla periódica del alemán Julius Lothar Meyer; y en 1869 una tabla periódica del ruso Dimitri Ivanovich Mendeleiev (1834-1907).
En las tablas del alemán y el ruso aparece, por primera vez, la idea de periodicidad y se utiliza el peso atómico como criterio para la ordenación. Ambos habían asistido al congreso de Karslruhe y comprendido la importancia de las ideas de Cannizaro. Vemos, en definitiva, que la idea de una tabla periódica es obra de todo un colectivo de científicos que tratan de resolver un problema. La propuesta final más aceptada y hoy más conocida es sin duda la del ruso Mendeleiev. Su éxito se debió a que mientras que Meyer pensaba que los huecos que había en su ordenación periódica eran debidos a una imperfección en la tabla, el ruso lanzó un desafío a la comunidad científica: "Los huecos no eran errores, eran elementos que faltaban por descubrir y que debían tener ciertas propiedades que la tabla le ayudaba a predecir". Y así se fue comprobando, en vida de Mendeleiev, al descubrirse el galio, el escandio y el germanio. Todos ellos situados en los lugares donde predecía el químico ruso, con los nombres de eka-alumnio, eka-boro y eka-silicio. En su forma más reconocible (ver imagen de la Tabla en la imagen de apertura de la noticia), la tabla fue diseñada en 1871 por el propio Mendeleiev al cambiar las filas por columnas respecto a sus esbozos iniciales (figura 2).
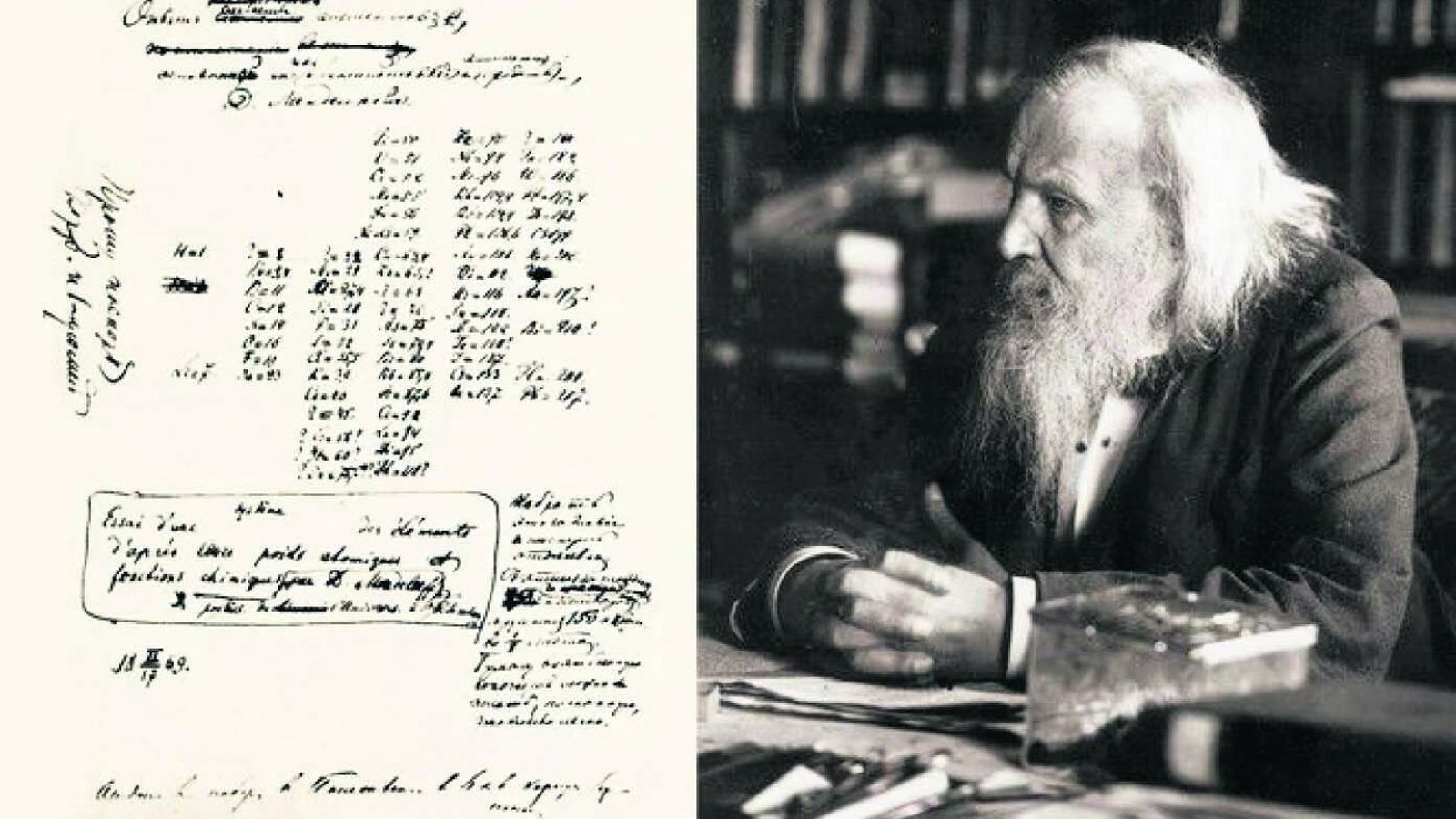
La tabla periódica tiene dos partes comunes en todas las lenguas del mundo: el número atómico y el símbolo, que se representa con una o dos letras, escribiéndose la primera en mayúsculas. Sin embargo, el nombre del elemento cuando se escribe en la lengua propia debe escribirse en minúsculas, como un nombre común y debe evitarse escribirlo en mayúscula; un error habitual entre los estudiantes. Desde 2016 se conocen 118 elementos químicos, tras la aprobación de los elementos de números atómicos 113 (nihonio, Nh), 115 (moscovio, Mc), 117 (teneso, Ts) y 118 (oganesón, Og); completándose el periodo séptimo de la tabla periódica de 18 columnas.
Cuando yo la estudié, como todo buen estudiante de ciencias, tenía solo 103 elementos, aunque las tierras raras (lantánidos y actínidos) no las memorizábamos pues no eran esenciales para poder "formular"; aquella tarea con la que soñábamos y sufríamos pesadillas todos los que decidíamos abrazar la escondida belleza de la química. La tabla de Mendeleiev, un icono de la ciencia, ha sido objeto de amor y odio por todos los estudiantes que se han enfrentado a ella. Aunque eso es, sin duda, otra historia que dejamos para otra ocasión.
También te puede interesar